ダニシェフスキーのタキソール全合成
ダニシェフスキーのタキソール全合成(ダニシェフスキーのタキソールぜんごうせい)は、1996年に米国有機化学者のサミュエル・ダニシェフスキーによって報告された[1]、ホルトン、ニコラウに続く3番目のタキソール全合成である。これらの成果は、有機化学の全合成への応用に佳良な知見を提供するものである。タキソール(パクリタキセル)は抗がん剤であるが入手が比較的困難であること、全合成によりさらに効果のある誘導体を設計できる可能性があることから、研究対象となっている。
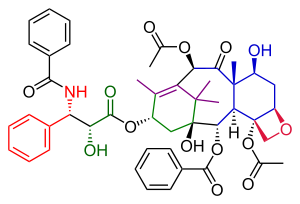
尾島ラクタム(橙)、尾島ラクタムとアクリル酸クロリド(緑)、2-メチル-3-ペンタノン(紫)、ウィーランド・ミーシャーケトン(青)、過酸化水素(赤)などを出発物質とする。

ダニシェフスキーの合成経路はニコラウのものと多くの点で類似している。それらはともに二つの前駆体から得たA環とC環を結合させるもので、収束的合成法の好例である。ダニシェフスキー法の特徴は、8員環B環の構築の前に、シクロヘキサノールC環上のオキセタンD環を形成するところにある。基本骨格を作るうえでの最初の出発物質はウィーランド・ミーシャーケトンで、これは単一のエナンチオマーとして市販品が入手可能である。この化合物に含まれる1個の不斉炭素原子から、最終的に得られるタキソール分子全体の不斉点へ導いてゆく。最終段階はニコラウ法と同じく尾部の付加であり、尾島らによって開発された方法[2]を利用する。
原料化合物は上記のウィーランド・ミーシャーケトンのほか、2-メチル-3-ペンタノン、水素化アルミニウムリチウム、四酸化オスミウム、フェニルリチウム、クロロクロム酸ピリジニウム、コーリー・チャイコフスキー試薬、アクリル酸クロリドである。鍵となる段階はコーリー・チャイコフスキー反応とヘック反応である。
逆合成解析
編集逆合成解析を以下に示す。
|
|
| Retrosynthesis |
|---|
D環の合成
編集下式にウィーランド・ミーシャーケトンから始まるC環・オキセタンD環の合成を示す。まず、ケトン 1 を水素化ホウ素ナトリウムで還元してアルコール 2 とし、これを無水酢酸、ジメチルアミノピリジン、ピリジンでアセチル化して保護する (3)。ケトン基もナフタレンスルホン酸を触媒としたエチレングリコールとの反応でアセタール 4 として保護する。このとき二重結合の異性化が同時に起こる。次にアセチル基をナトリウムエトキシドで脱保護し、tert-ブチルジメチルシリルトリフラートと2,6-ルチジンでTBDMS基として保護しなおす。化合物 4 の二重結合は、ヒドロホウ素化とそれに続く過酸化水素による分解によってヒドロキシ基に変換される (5)。このヒドロキシ基は二クロム酸ピリジニウムで酸化してケトン 6 とする。それから、他の二つの官能基が不活性化された状態にあるうちに、オキセタン環の作成を行う。まず必要とされるメチレン基を、コーリー・チャイコフスキー反応によってカルボニル基をエポキシド 7 とすることで導入する。アルミニウムイソプロポキシドによるエポキシドの開環と、それに続く脱離反応によってアリルアルコール 8 を得る。ここで新たに生成した二重結合に、四酸化オスミウム触媒と再酸化剤 N-メチルモルホリン N-オキシドで、2個のヒドロキシ基を付加する。この反応は立体特異的に進行しないため、望みの立体化学を持つトリオール 9 の収率は高くない。次に、1級アルコールをピリジン中、塩化トリメチルシランでシリルエーテル 10 として保護し、2級アルコールをトリフルオロメタンスルホン酸無水物でトリフラート 11 に変換する。これで、良い求核剤と良い脱離基がアンチ型の立体配置で用意された。最後に 11 をエチレングリコール中で加熱還流して分子内ウィリアムソン反応を起こし、オキセタン 12 を得る。
C環の合成
編集次の段階では、ウィーランド・ミーシャーケトンの右6員環を修飾してC環を作り、左6員間を開いてA環との二つの接続点を成形する。相間移動触媒として4級アンモニウム塩の存在下に、臭化ベンジルと水素化ナトリウムで 12 のアルコールをベンジルエーテル 13 として保護する。パラトルエンスルホン酸でアセタールを脱保護してケトン 14 に戻し、トリメチルシリルトリフラートでシリルエノールエーテル 15 としたのち、ロボトム酸化に付すとアシロイン 16 が得られる。さらに、メタノール中、酢酸鉛(IV) で炭素−炭素結合の酸化的解裂を起こすと、メチルエステルとアルデヒドを持つ 17 が生成する。そのあと、アルデヒドを2,4,6-トリメチルピリジニウムパラトルエンスルホナート (CPTS) 触媒とメタノールでアセタール化し、エステルを水素化アルミニウムリチウムでアルコールへと還元する (18)。このアルコールはグリエコ脱離でセレニド 19 を経て過酸化水素での酸化によりアルケン 20 に変換される。トリフェニルホスフィン存在下にオゾン分解を行うと、アルデヒド 21 が得られる。
A環の合成
編集A環前駆体の骨格はシクロヘキサン環で、二つの官能基、つまりビニルリチウム部位と保護済みのエノラート基を持つ。この二つでC環との連結を行い、8員環B環を形成する。この手法はニコラウ法と同様である。
出発物質は2-メチル-3-ペンタノン(エチルイソプロピルケトン) 22 で、これにモルホリンを脱水縮合してエナミン 23 とする。アクリル酸クロリド(塩化アクリロイル)との求核共役付加、求核アシル置換を連続して起こすことにより、シクロヘキサノン 24 を得る。次にモルホリンを加水分解して除去する。ジオン 25 をエタノール中、トリエチルアミン存在下にヒドラジンと反応させてヒドラゾン 26 とし、ヨウ素とジアザビシクロノネン (DBN) でヨウ素化する (27)。この反応で目的とするのは 27 であるが、予期せぬ脱水素化が起こり、実際にはジエン 28 が単離された。ケトンはシアノヒドリン 29 へと変換されるが、これにはトリメチルシリルシアニド、シアン化カリウム、クラウンエーテルが用いられた。最後に、テトラヒドロフラン中、−78°Cで tert-ブチルリチウムによってリチオ化し、ビニルリチウム 30 を得る。
B環の合成
編集B環下部の接続は、A環部分を持つビニルリチウム 30 を 21 のC環アルデヒド部位へ求核付加させることにより行われる。生成物のトリメチルシリル基 (TMS) をテトラブチルアンモニウムフルオリド (TBAF) で脱保護し、ケトン基を再生して 31 を得る。次に、二重結合のひとつをメタクロロ過安息香酸 (MCPBA) で酸化し、エポキシド 32 とする。これをパラジウム炭素触媒の存在下に水素化してジオール 33 とし、生成したヒドロキシ基はジメチルホルムアミド溶媒中でカルボニルジイミダゾールと水素化ナトリウムを使って環状炭酸エステル 34 として保護する。それら二つのヒドロキシ基は、最終生成物であるタキソールの一部分となる。
A環合成におけるヒドラゾンのヨウ素化の際に予期せず生成していた 34 のアルケン部分は、水素化トリ-sec-ブチルホウ素リチウム (L-Selectride) で還元する。得られた 35 のケトン部分は、テトラヒドロフラン (THF) 中、−78°Cでカリウムヘキサメチルジシラジド (KHMDS) とフェニルトリフルイミドを作用させ、ビニルトリフラート 36 に変換される。これはヘック反応を行う際に必要となる官能基である。反応相手となる部位は以下のようにして調製する。上部のアセタールをピリジニウムパラトルエンスルホナート (PPTS) で脱保護してカルボニル基に戻して 37 とし、メチレントリフェニルホスホランとのウィッティヒ反応で末端アルケン 38 に変換する。38 の分子内ヘック反応はテトラキス(トリフェニルホスフィン)パラジウム(0) と炭酸カリウムの存在下、アセトン中で加熱還流することによって行う。この環化によってB環の骨格ができあがった (39)。
続いて、A環とC環を架橋している、B環のエチレン鎖上の置換基を適切なものに変える。39 の架橋部分は環外メチレンを持っているが、最終的にはα-アシルケトンにしなければならない。これは以下の10段階の反応によって行われる。
まず 39 の保護基、tert-ブチルジメチルシリル基 (TBDMS) をトリエチルシリル基 (TES) で置き換える (40)。次にA環の二重結合をMCPBAでエポキシド 41 に変換する。このエポキシドは環外アルケンに修飾を施す間、保護基として働く。それから、役目を終えたベンジル基 (Bn) をパラジウム炭素触媒を用いた水素化で脱保護し (42)、アセチル基 (Ac) で保護しなおして 43 とする(無水酢酸、ジメチルアミノピリジン、ピリジン)。炭酸エステル 43 をフェニルリチウムで開環してアルファ-ヒドロキシ安息香酸エステル 44 とする。そして、ピリジン中四酸化オスミウムで環外メチレンをオスメートエステル 45 としたのち、酢酸鉛(IV) で酸化的開裂をおこしてケトン 46 へと変換する。保護基であったエポキシド、はTHF中−78°Cでヨウ化サマリウムと無水酢酸によってアルケン 47 に戻す。カリウム tert-ブトキシドを 47 に作用させエノラートとしておき、これにフェニルセレネン酸無水物を反応させるとヒドロキシケトン(アシロイン) 48 が得られる。この反応は二酸化セレンによるアリル基の酸化と類似するものである。最後にヒドロキシ基をアセチル化して 49 とする。
尾部の付加
編集尾部の付加段階はニコラウ法と同様であり、尾島巌が開発した尾島ラクタムを用いる。まずA環にヒドロキシ基を導入する。クロロクロム酸ピリジニウム (PCC) で 49 をケトン 50 に変換したのち、水素化ホウ素ナトリウムで還元してアルコール体 51 を得る。これと尾島ラクタム 52 を反応させて 53 とし、ふたつのトリエチルシリル基 (TES) を脱保護すれば、タキソールが得られる。出発物質のウィーランド・ミーシャーケトンは既に適切な立体化学を持っているため、本合成で得られるタキソールは天然のものと同一の光学活性(旋光度)を有する。
脚注
編集- ^ Danishefsky, S. J.; Masters, J. J.; Young, W. B.; Link, J. T.; Snyder, L. B.; Magee, T. V.; Jung, D. K.; Isaacs, R. C. A.; Bornmann, W. G.; Alaimo, C. A.; Coburn, C. A.; Di Grandi, M. J. "Total synthesis of baccatin III and taxol." J. Am. Chem. Soc. 1996, 118, 2843–2859. doi:10.1021/ja952692a
- ^ Ojima, I.; Habus, I.; Zhao, M.; Zucco, M.; Park, Y. H.; Sun, C. M.; Brigaud, T. "New and efficient approaches to the semisynthesis of taxol and its C-13 side chain analogs by means of β-lactam synthon method." Tetrahedron 1992, 48, 6985–7012. doi:10.1016/S0040-4020(01)91210-4