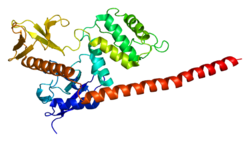
モエシン
モエシン(Moesin)は、ヒトではMSN遺伝子によりコードされるタンパク質である[5][6]。
Membrane-Organizing Extension Spike proteINの略であり、エズリン、ラディキシンとともにERMファミリーを構成する。ERMファミリーは、アクチンからなる細胞骨格と細胞膜との間の架橋として機能していると考えられている[7]。
相互作用
編集モエシンは、以下のタンパク質とタンパク質間相互作用する。
出典
編集- ^ a b c GRCh38: Ensembl release 89: ENSG00000147065 - Ensembl, May 2017
- ^ a b c GRCm38: Ensembl release 89: ENSMUSG00000031207 - Ensembl, May 2017
- ^ Human PubMed Reference:
- ^ Mouse PubMed Reference:
- ^ “Moesin: a member of the protein 4.1-talin-ezrin family of proteins”. Proc. Natl. Acad. Sci. U.S.A. 88 (19): 8297-301. (Oct 1991). doi:10.1073/pnas.88.19.8297. PMC 52495. PMID 1924289.
- ^ “Subcellular localization of moesin in dynamic filopodia, retraction fibers, and other structures involved in substrate exploration, attachment, and cell-cell contacts”. Exp. Cell Res. 219 (1): 180-96. (Sep 1995). doi:10.1006/excr.1995.1218. PMID 7628534.
- ^ a b “Entrez Gene: MSN moesin”. 2020年3月31日閲覧。
- ^ “CD43 interacts with moesin and ezrin and regulates its redistribution to the uropods of T lymphocytes at the cell-cell contacts”. Blood 91 (12): 4632-44. (Jun 1998). PMID 9616160.
- ^ “Ezrin/radixin/moesin (ERM) proteins bind to a positively charged amino acid cluster in the juxta-membrane cytoplasmic domain of CD44, CD43, and ICAM-2”. J. Cell Biol. 140 (4): 885-95. (Feb 1998). doi:10.1083/jcb.140.4.885. PMC 2141743. PMID 9472040.
- ^ “Moesin interacts with the cytoplasmic region of intercellular adhesion molecule-3 and is redistributed to the uropod of T lymphocytes during cell polarization”. J. Cell Biol. 138 (6): 1409-23. (Sep 1997). doi:10.1083/jcb.138.6.1409. PMC 2132557. PMID 9298994.
- ^ “A novel serine-rich motif in the intercellular adhesion molecule 3 is critical for its ezrin/radixin/moesin-directed subcellular targeting”. J. Biol. Chem. 277 (12): 10400-9. (Mar 2002). doi:10.1074/jbc.M110694200. PMID 11784723.
- ^ a b “The NADPH oxidase components p47(phox) and p40(phox) bind to moesin through their PX domain”. Biochem. Biophys. Res. Commun. 289 (2): 382-8. (Nov 2001). doi:10.1006/bbrc.2001.5982. PMID 11716484.
- ^ “Dynamic interaction of VCAM-1 and ICAM-1 with moesin and ezrin in a novel endothelial docking structure for adherent leukocytes”. J. Cell Biol. 157 (7): 1233-45. (Jun 2002). doi:10.1083/jcb.200112126. PMC 2173557. PMID 12082081.
- ^ “Cytoskeleton-mediated death receptor and ligand concentration in lipid rafts forms apoptosis-promoting clusters in cancer chemotherapy”. J. Biol. Chem. 280 (12): 11641-7. (Mar 2005). doi:10.1074/jbc.M411781200. PMID 15659383.
- ^ “Ezrin self-association involves binding of an N-terminal domain to a normally masked C-terminal domain that includes the F-actin binding site”. Mol. Biol. Cell 6 (8): 1061-75. (Aug 1995). doi:10.1091/mbc.6.8.1061. PMC 301263. PMID 7579708.
- ^ “Heterotypic and homotypic associations between ezrin and moesin, two putative membrane-cytoskeletal linking proteins”. Proc. Natl. Acad. Sci. U.S.A. 90 (22): 10846-50. (Nov 1993). doi:10.1073/pnas.90.22.10846. PMC 47875. PMID 8248180.
関連文献
編集- “ERM (ezrin/radixin/moesin) family: from cytoskeleton to signal transduction”. Curr. Opin. Cell Biol. 9 (1): 70-5. (1997). doi:10.1016/S0955-0674(97)80154-8. PMID 9013673.
- “The ezrin protein family: membrane-cytoskeleton interactions and disease associations”. Curr. Opin. Cell Biol. 9 (5): 659-66. (1997). doi:10.1016/S0955-0674(97)80119-6. PMID 9330869.
- “Human immunodeficiency virus (HIV)-1 proteins and cytoskeleton: partners in viral life and host cell death”. Cell Death Differ. 12 Suppl 1: 932-41. (2005). doi:10.1038/sj.cdd.4401582. PMID 15818415.
- “Ezrin self-association involves binding of an N-terminal domain to a normally masked C-terminal domain that includes the F-actin binding site”. Mol. Biol. Cell 6 (8): 1061-75. (1995). doi:10.1091/mbc.6.8.1061. PMC 301263. PMID 7579708.
- “Differential expression of the microspike-associated protein moesin in human tissues”. Eur. J. Cell Biol. 67 (3): 189-98. (1995). PMID 7588875.
- “Physical association of moesin and CD46 as a receptor complex for measles virus”. J. Virol. 69 (4): 2248-56. (1995). PMC 188894. PMID 7884872.
- “Structure and localization on the X chromosome of the gene coding for the human filopodial protein moesin (MSN)”. Genomics 19 (2): 326-33. (1994). doi:10.1006/geno.1994.1065. PMID 8188263.
- “Heterotypic and homotypic associations between ezrin and moesin, two putative membrane-cytoskeletal linking proteins”. Proc. Natl. Acad. Sci. U.S.A. 90 (22): 10846-50. (1993). doi:10.1073/pnas.90.22.10846. PMC 47875. PMID 8248180.
- “Moesin: a cell membrane protein linked with susceptibility to measles virus infection” (Submitted manuscript). Virology 198 (1): 265-74. (1994). doi:10.1006/viro.1994.1029. PMID 8259662.
- “Phosphorylation of threonine 558 in the carboxyl-terminal actin-binding domain of moesin by thrombin activation of human platelets”. J. Biol. Chem. 270 (52): 31377-85. (1995). doi:10.1074/jbc.270.52.31377. PMID 8537411.
- “Cytoskeletal proteins inside human immunodeficiency virus type 1 virions”. J. Virol. 70 (11): 7734-43. (1996). PMC 190843. PMID 8892894.
- “Specific binding of HIV-1 envelope protein gp120 to the structural membrane proteins ezrin and moesin”. Virus Res. 49 (2): 215-23. (1997). doi:10.1016/S0168-1702(97)00039-7. PMID 9213396.
- “Moesin interacts with the cytoplasmic region of intercellular adhesion molecule-3 and is redistributed to the uropod of T lymphocytes during cell polarization”. J. Cell Biol. 138 (6): 1409-23. (1997). doi:10.1083/jcb.138.6.1409. PMC 2132557. PMID 9298994.
- “Identification of EBP50: A PDZ-containing phosphoprotein that associates with members of the ezrin-radixin-moesin family”. J. Cell Biol. 139 (1): 169-79. (1997). doi:10.1083/jcb.139.1.169. PMC 2139813. PMID 9314537.
- “NHE-RF, a regulatory cofactor for Na(+)-H+ exchange, is a common interactor for merlin and ERM (MERM) proteins”. J. Biol. Chem. 273 (3): 1273-6. (1998). doi:10.1074/jbc.273.3.1273. PMID 9430655.
- “Ezrin/radixin/moesin (ERM) proteins bind to a positively charged amino acid cluster in the juxta-membrane cytoplasmic domain of CD44, CD43, and ICAM-2”. J. Cell Biol. 140 (4): 885-95. (1998). doi:10.1083/jcb.140.4.885. PMC 2141743. PMID 9472040.