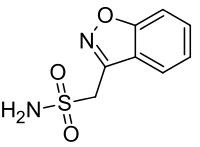
ゾニサミド
ゾニサミド(Zonisamide)は、サルファ薬系の神経作用薬であり、小児または成人のてんかん発作(部分発作、全般発作、混合発作)治療薬[2]またはパーキンソン病治療薬[3]として用いられる[4]。抗てんかん薬は商品名エクセグラン、抗パーキンソン病薬トレリーフで知られる。(ともに住友ファーマ製造販売)
 | |
 | |
| IUPAC命名法による物質名 | |
|---|---|
| |
| 臨床データ | |
| 販売名 | エクセグラン, トレリーフ, Zonegran |
| Drugs.com | monograph |
| MedlinePlus | a603008 |
| 胎児危険度分類 | |
| 法的規制 | |
| 薬物動態データ | |
| 生物学的利用能 | ~100%[1] |
| 血漿タンパク結合 | 40%[1] |
| 代謝 | 肝臓で主に CYP3A4による[1] |
| 半減期 | 63 時間[1] |
| 排泄 | 尿中 (62%); 糞便中 (3%)[1] |
| データベースID | |
| CAS番号 |
68291-97-4 |
| ATCコード | N03AX15 (WHO) |
| PubChem | CID: 5734 |
| DrugBank |
DB00909 |
| ChemSpider |
5532 |
| UNII |
459384H98V |
| KEGG |
D00538 |
| ChEBI |
CHEBI:10127 |
| ChEMBL |
CHEMBL750 |
| PDB ligand ID | ZON (PDBe, RCSB PDB) |
| 化学的データ | |
| 化学式 | |
| 分子量 | 212.227 g/mol |
| |
| 物理的データ | |
| 融点 | 162 °C (324 °F) |
効能・効果
編集てんかん
編集ゾニサミドは米国[5]、英国[6]、豪州[7][8]では成人のてんかん部分発作の併用治療薬として、日本では部分発作(単純部分発作、複雑部分発作、二次性全般化強直間代痙攣)、全般発作(強直発作、強直間代発作、非定型欠神発作)、混合発作への併用または単剤治療薬として認められている。てんかんに対しては成人では1日200mg〜600mg、小児では1日4〜12mg/kgを投与する。血中濃度が15〜40µg/mLとなるよう調整する[9][10][11][12]。日本の添付文書では、20µg/mLを一つの目安とするよう記載されている[2]。
パーキンソン病
編集7人のパーキンソン病患者にゾニサミドを投与したところ、良好な結果が得られた事が2001年に報告された[13]。その後、他の治療で改善しない振戦について効果が認められた[14]。2005年11月上旬、製造販売承認が申請され[15]、2009年1月に承認を取得した[16]。また、パーキンソン病のWearing-off現象について2013年8月に追加承認(用法・用量の一部変更)された[17]。
レビー小体型認知症
編集製品名トレリーフが、レビー小体型認知症に伴うパーキンソニズムの適応を取得している。(製品名エクセグラン[18]や後発品[19]は適応を有していない。)
遅発性ジスキネジア
編集非盲検の臨床試験で遅発性ジスキネジアの軽減が認められた[20]。
肥満
編集肥満治療薬としての研究が進められ[21]、著明な効果が認められた事を受けて、3本の臨床試験が実施された[22][23][24]。ブプロピオンとの合剤として米国で販売されている。
片頭痛・神経因性疼痛
編集ゾニサミドは片頭痛の予防に用いられるほか、神経因性疼痛の治療に有効であることがある。
双極性障害
編集適応外使用であるが、精神科領域で双極性障害に対して気分安定剤として用いられる[25][26]。
アルコール依存症
編集日本では適応外である。プラセボ、ゾニサミド、トピラマート、レベチラセタムとで比較し、ゾニサミドの有効性と安全性が示唆された[27]。
副作用
編集添付文書に重大な副作用として記載されているものは、中毒性表皮壊死症(Toxic Epidermal Necrolysis:TEN)、皮膚粘膜眼症候群(Stevens-Johnson症候群)[28]、紅皮症(剥脱性皮膚炎)、薬剤性過敏症候群、再生不良性貧血、無顆粒球症、赤芽球癆、血小板減少、急性腎不全、間質性肺炎、肝機能障害、黄疸、横紋筋融解症、腎・尿路結石、発汗減少に伴う熱中症、悪性症候群であり、さらにトレリーフには幻覚、妄想、錯乱、せん妄などの精神症状が記載されている[2][3][1][29][30]。
相互作用
編集ゾニサミドや他の炭酸脱水酵素阻害薬(トピラマート、フロセミド、ヒドロクロロチアジド)は、アモバルビタールとの間で相互作用し、和田試験の結果が不正確になることが知られている[31]。他の炭酸脱水酵素阻害薬と相互作用し、代謝性アシドーシスを惹起することがある[1]。加えて、ゾニサミドの代謝がケトコナゾール、シクロスポリン、ミコナゾール、フルコナゾール、カルバマゼピンで抑制されることが知られている(CYP3A4への作用による)[32]。
作用機序
編集ゾニサミドは他の抗痙攣薬と異なり、スルホンアミド系に分類される抗痙攣薬である。正確な作用機序は明らかになっていないが、抗てんかん薬としては発作活動の伝播過程の遮断、てんかん原性焦点の抑制等が示唆されている[33][34]。またナトリウムチャネルおよびT型カルシウムチャネルを塞ぎ、hypersynchronization を抑制すると考えられている[7]。アセタゾラミド同様に弱い炭酸脱水酵素阻害作用を持つことが知られている。GABA受容体ならびにグルタミン酸受容体調整作用がある[7][35][36][37][38]。抗パーキンソン病作用に関しては、片側6-OHDA処置ラットによる脳微小透析法実験でレボドパ(ベンセラジド塩酸塩含有)併用下における破壊側線条体細胞外液中ドパミン濃度の有意な上昇作用を示した他、ラットおよびサル線条体ミトコンドリア・シナプトソーム膜標本中のMAO活性を阻害し、その阻害作用は比較的MAOのB型に選択性を示した[3]。
薬物動態
編集吸収
編集個人差があるが、2.8〜3.9時間で血中濃度がピークとなる。バイオアベイラビリティは食事の影響を受けない[39]。
代謝
編集ゾニサミドは主にCYP3A4で代謝されるほか、CYP3A7およびCYP3A5でも分解され[40]、1,2-ベンズイソオキサゾール環が還元的に開裂して2-(スルファモイルアセチル)-フェノールに代謝される[41]。
発売の経緯
編集ゾニサミドは1972年に発見され[42]、1989年にエクセグランとして日本で発売された[43]。米国では2000年にZonegranとして発売された。アジア諸国(中国、台湾等14ヶ国)[44]や欧州(ドイツ、英国等)[45]でも2005年に発売された。
出典
編集- ^ a b c d e f g “Zonegran Product Information” (PDF). TGA eBusiness Services. SciGen (Australia) Pty Ltd (4 April 2013). 18 November 2013閲覧。
- ^ a b c “エクセグラン錠100mg/エクセグラン散20% 添付文書”. 2015年1月11日閲覧。
- ^ a b c “トレリーフ錠25mg 添付文書”. 2015年1月11日閲覧。
- ^ Comprehensive Pharmacy Review, Leon Shargel, 6th edition, p988
- ^ Élan Pharmaceuticals Inc (2003年8月22日). “NDA 20-789/S-001; Zonegran (zonisamide) Capsules 25, 50, 100 mg FDA Approvable Labeling Text” (PDF). Zonisamide Approval History. Food and Drug Administration. 2009年8月24日閲覧。
- ^ Eisai Ltd. (2005年). “Zonegran Summary of Product Characteristics”. electronic Medicines Compendium. Medicines.org.uk. 2005年11月13日閲覧。
- ^ a b c Rossi, S, ed (2013). Australian Medicines Handbook (2013 ed.). Adelaide: The Australian Medicines Handbook Unit Trust. ISBN 978-0-9805790-9-3
- ^ Dainippon Pharmaceutical Co., Ltd. (2004年). “EXCEGRAN Tablets 100 mg & EXCEGRAN Powder 20%” (PDF). 2006年3月13日閲覧。
- ^ Shimizu A, Ikoma R, & Shimizu T: Effects and side effects of zonisamide during long-term medication. Curr Ther Res 1990; 47:696-706
- ^ Iinuma K, Handa I, Fueki N, et al: Effects of zonisamide (AD-810) on refractory epilepsy in children: special reference to temporal lobe abnormalities. Curr Ther Res 1988; 43:281-282
- ^ Sakamoto K, Kurokawa T, Tomita S, et al: Effects of zonisamide in children with epilepsy. Curr Ther Res 1988; 43:378-383
- ^ Shimizu A, Yamamoto J, Yamada Y, et al: The antiepileptic effect of zonisamide in patients with refractory seizures. Curr Ther Res 1987; 42:147-155
- ^ Murata, Miho; Horiuchi Emiko and Kanazawa Ichiro (December 2001). “Zonisamide has beneficial effects on Parkinson's disease patients”. Neuroscience Research 41 (4): 397–9. doi:10.1016/S0168-0102(01)00298-X. PMID 11755227.
- ^ Nakanishi, I; Kohmoto J; Miwa H; Kondo T (August 2003). “[Effect of zonisamide on resting tremor resistant to antiparkinsonian medication]”. No to Shinkei 55 (8): 685–9. PMID 13677302.
- ^ Dainippon Sumitomo Pharma Co., Ltd. (2005年). “New Drugs in the R&D Pipeline (under development by DSP)” (PDF). List of Product Development Project. 2006年2月13日時点のオリジナルよりアーカイブ。2005年11月21日閲覧。
- ^ “パーキンソン病治療剤「トレリーフ」の製造販売承認取得について”. 大日本住友製薬 (2009年1月21日). 2015年1月11日閲覧。
- ^ “パーキンソン病治療剤「トレリーフ錠25mg」の用法・用量の一部変更承認取得について”. 大日本住友製薬 (2013年8月20日). 2015年1月11日閲覧。
- ^ https://www.kegg.jp/medicus-bin/japic_med_product?id=00050122-001#00050122-001
- ^ https://www.kegg.jp/medicus-bin/japic_med_product?id=00067969-001#00067969-001
- ^ Iwata, Y; Irie, S; Uchida, H; Suzuki, T; Watanabe, K; Iwashita, S; Mimura, M (15 April 2012). “Effects of zonisamide on tardive dyskinesia: a preliminary open-label trial”. Journal of the Neurological Sciences 315 (1-2): 137-140. doi:10.1016/j.jns.2011.12.010. PMID 22285275.
- ^ Gadde, Kishore M.; Deborah M. Franciscy, H. Ryan Wagner, II; K. Ranga R. Krishnan (April 2003). “Zonisamide for Weight Loss in Obese Adults: A Randomized Controlled Trial”. Journal of the American Medical Association 289 (14): 1820–1825. doi:10.1001/jama.289.14.1820. PMID 12684361.
- ^ University of Cincinnati (2005年). “Zonegran in the Treatment of Binge Eating Disorder Associated With Obesity”. ClinicalTrials.gov. 2006年5月4日閲覧。
- ^ Tuscaloosa Research & Education Advancement Corporation (2005年). “Zonegran for the Treatment of Weight Gain Associated With Psychotropic Medication Use: A Placebo-Controlled Trial”. ClinicalTrials.gov. 2006年5月4日閲覧。
- ^ National Institute of Diabetes and Digestive and Kidney Diseases (NIDDK) (2006年). “Zonisamide for Weight Reduction in Obese Adults”. ClinicalTrials.gov. 2006年5月4日閲覧。
- ^ Dr. Brian D. Loftus (2004年). “Zonegran”. 2006年11月29日閲覧。
- ^ Hasegawa, Hisanori (May 2004). “utilization of zonisamide in patients with chronic pain or epilepsy refractory to other treatments: a retrospective, open label, uncontrolled study in a VA hospital”. Curr Med Research Opinion 20 (5): 577–580. doi:10.1185/030079904125003313. PMID 15140322.
- ^ Knapp CM, et al. Zonisamide, topiramate, and levetiracetam: efficacy and neuropsychological effects in alcohol use disorders. J Clin Psychopharmacol. 2015; 35(1): 34-42. doi: 10.1097/JCP.0000000000000246.
- ^ 厚生労働省医薬食品局 医薬品・医療機器等安全性情報261号 2009;261:3-8.
- ^ “Zonegran 25, 50, 100 mg Hard Capsules”. elecronic Medicines Compendium. Eisai Ltd (8 October 2013). 18 November 2013閲覧。
- ^ “zonisamide (Rx) - Zonegran”. Medscape Reference. WebMD. 18 November 2013閲覧。
- ^ Bookheimer, Susan; Schrader, Lara M.; Rausch, Rebecca; Sankar, Raman; Engel, Jerome Jr. (February 2005). “Reduced anesthetization during the intracarotid amobarbital (Wada) test in patients taking carbonic anhydrase-inhibiting medications”. Epilepsia 46 (2): 236–43. doi:10.1111/j.0013-9580.2005.23904.x. PMID 15679504.
- ^ Nakasa, H.; Nakamura H; Ono S; Tsutsui M; Kiuchi M; Ohmori S; Kitada M. (April 1998). “Prediction of drug-drug interactions of zonisamide metabolism in humans from in vitro data”. European Journal of Clinical Pharmacology 54 (2): 177–83. doi:10.1007/s002280050442. PMID 9626925.
- ^ Masuda, Y., et al. (1980). J.Pharm.Dyn 3: 526.
- ^ Ito, T., et al. (1980). Arzneim.-Forsch./Drug Res. 30: 603.
- ^ Leppik, Ilo E. (December 2004). “Zonisamide: chemistry, mechanism of action, and pharmacokinetics”. Seizure 13 (Suppl 1): S5–9; discussion S10. doi:10.1016/j.seizure.2004.04.016. PMID 15511691.
- ^ Mimaki, T; Suzuki, Y; Tagawa, T; Karasawa, T; Yabuuchi, H (March 1990). “Interaction of zonisamide with benzodiazepine and GABA receptors in rat brain”. Medical Journal of Osaka University 39 (1-4): 13–7. PMID 1369646.
- ^ Mimaki, T; Suzuki, Y; Tagawa, T; Karasawa, T; Yabuuchi, H (March 1990). “[3H]zonisamide binding in rat brain”. Medical Journal of Osaka University 39 (1-4): 19–22. PMID 1369647.
- ^ Ueda, Y; Doi, T; Tokumaru, J; Willmore, J (2003-08-19). “Effect of zonisamide on molecular regulation of glutamate and GABA transporter proteins during epileptogenesis in rats with hippocampal seizures”. Molecular Brain Research 116 (1-2): 1–6. doi:10.1016/S0169-328X(03)00183-9. PMID 12941455.
- ^ http://www.drugbank.ca/drugs/DB00909
- ^ Ohmori, S.; Nakasa H; Asanome K; Kurose Y; Ishii I; Hosokawa M; Kitada M (1998-05-08). “Differential catalytic properties in metabolism of endogenous and exogenous substrates among CYP3A enzymes expressed in COS-7 cells”. Biochimica et Biophysica Acta 1380 (3): 297–304. doi:10.1016/s0304-4165(97)00156-6. PMID 9555064.
- ^ Stiff, D. D.; Robicheau JT; Zemaitis MA. (January 1992). “Reductive metabolism of the anticonvulsant agent zonisamide, a 1,2-benzisoxazole derivative”. Xenobiotica 22 (1): 1–11. doi:10.3109/00498259209053097. PMID 1615700.
- ^ Shah, Jaymin; Kent Shellenberger; Daniel M. Canafax (2002-06-15) [1972]. “Zonisamide”. In René H. Levy, Richard H. Mattson, Brian S. Meldrum, and Emilio Perrucca (ed.). Antiepileptic Drugs (Fifth ed.). Philadelphia: Lippincott Williams & Wilkins. p. 873. ISBN 0-7817-2321-3 2007年11月7日閲覧。
- ^ Dainippon Sumitomo Pharma Co., Ltd. (2005年). “Company History”. Company Information. Dainippon Sumitomo Co., Ltd.. 2006年2月13日時点のオリジナルよりアーカイブ。2005年11月12日閲覧。
- ^ Dainippon Pharmaceutical Co., Ltd. (2005年). “Dainippon Pharmaceutical and Eisai Conclude Agreement for the Development, Manufacture and Marketing of the Anti-Epileptic Agent Zonisamide in Asia”. Dainippon Pharmaceutical News Releases for 2005. Dainippon Sumitomo Pharma Co., Ltd.. 2006年2月22日時点のオリジナルよりアーカイブ。2005年11月12日閲覧。
- ^ Eisai Co., Ltd. (2005年). “Eisai Announces Launch of Zonegran (zonisamide), Treatment For Epilepsy In the UK and Germany”. Eisai 2005 News Releases. Eisai Co., Ltd.. 12 November 2005閲覧。