ジアゼン
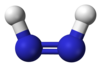
ジアゼン(Diazene)またはジイミン(diimine)、ジイミド(diimide)は、分子式 N2H2 の化合物である。E とZ の2つの幾何異性体を持つ。あるいはまた(NR)2の化学式を持つアゾ化合物の関連化合物のことである。たとえばアゾベンゼンは、ジアゼンの1つである。
| ジアゼン | |
|---|---|

|

|
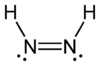
|
|
Diazene | |
別称 Diimide Diimine | |
| 識別情報 | |
| CAS登録番号 | 3618-05-1 |
| PubChem | 123195 |
| ChemSpider | 10612167 |
| KEGG | C05360 |
| MeSH | Diazene |
| ChEBI | |
| |
| |
| 特性 | |
| 化学式 | H2N2 |
| モル質量 | 30.03 g mol−1 |
| 示性式 | (NH)2 |
| 精密質量 | 30.021798074 g mol-1 |
| 外観 | 黄色気体 |
| 融点 |
-80 °C, 193 K, -112 °F |
| 関連する物質 | |
| その他の陰イオン | ジホスフェン 二フッ化二窒素 |
| その他の陽イオン | アゾ化合物 |
| 関連する二価のアザン | アンモニア ヒドラジン トリアザン |
| 関連物質 | トリアゼン テトラゼン |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
合成と反応
編集ジアゼンを生成する伝統的な方法は、過酸化水素または空気によるヒドラジンの酸化である[1]。または、以下のようにアゾジカルボン酸の脱炭酸によっても生成される[2]。
さらに、適当な塩基を用いてスルホノヒドラジドから脱離することでも効率的に生成できる。たとえば、2,4,6-トリイソプロピルベンゼンスルホノヒドラジドを炭酸水素ナトリウムで処理することで、ジアゼンを脱離することができる。
その不安定性のため、ジアゼンはin-situ(その場)で、生成して直ちに利用される。シス体とトランス体の混合物が生成される。どちらの異性体も不安定で、ゆっくり相互変換する。トランス体の方がより安定であるが、シス体は不飽和基質と結合するため、この2者間の平衡は、ルシャトリエの原理に従って、シス体の方に移動する。ジアゼンは、容易に分解する。低い温度でさえ、より安定なトランス体が、たとえばヒドラジンや窒素ガスを生成するような、様々な不均化反応を起こす[3]。
この競合的な分解反応のため、ジアゼンによる還元は、多量の前駆体を必要とする。
有機合成への利用
編集シス体のジアゼンは、有機合成にとって有益なことがある[4]。基質の一方の面に対してアルケンやアルキンを水素化し、金属触媒で、水素分子が全てsyn付加した立体異性となる。放出される唯一の共生成物は、窒素ガスである。方法は煩雑であっても、ジアゼンの利用は、高圧や爆発性の水素や高価な金属触媒の利用等を避けることができる[5]。水素化の機構は、六員環のC2H2N2遷移状態を経る。
選択性
編集ジアゼンは、アルケンとアルキンを選択的に還元し、通常の触媒水素を妨げる官能基には反応しない点で有利である。従って、過酸化物、ハロゲン化アルキル、チオールは、ジアゼンに対して抵抗性を持つが、これらの官能基は金属触媒によっては分解される。この試薬は、アルキンと直鎖のアルケンを[1]、対応するアルケンとアルカンに好んで還元する[4]。
出典
編集- ^ a b Ohno, M.; Okamoto, M. (1973). "cis-Cyclododecene". Organic Syntheses (英語).; Collective Volume, vol. 5, p. 281
- ^ Wiberg, E.; Holleman, A. F. (2001). “1.2.7: Diimine, N2H2”. Inorganic Chemistry. Elsevier. p. 628. ISBN 9780123526519
- ^ Wiberg, Nils; Holleman, A. F.; Wiberg, Egon, eds (2001). “1.2.7 Diimine N2H2 [1.13.17]”. Inorganic Chemistry. Academic Press. pp. 628–632. ISBN 978-0123526519
- ^ a b Pasto, D. J. (2001). "Diimide". Encyclopedia of Reagents for Organic Synthesis. John Wiley & Sons. doi:10.1002/047084289X.rd235。
- ^ Miller, C. E. (1965). “Hydrogenation with Diimide”. Journal of Chemical Education 42 (5): 254–259. doi:10.1021/ed042p254.