γ-セクレターゼ
γ-セクレターゼ(英: gamma secretase)は、複数のサブユニットからなるプロテアーゼ複合体で、膜内切断プロテアーゼ(膜貫通タンパク質を膜貫通ドメイン内で切断するプロテアーゼ)の一種である。アルツハイマー病の発病と関わりがあると考えられている。
| Gamma-secretase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
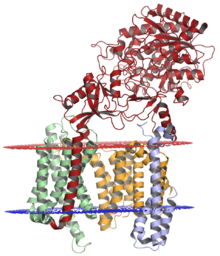 γ-セクレターゼ複合体。プレセニリン-1(橙)、ニカストリン(赤)、PEN-2 (青)、APH-1(緑)で構成される。内腔側が上(赤)、細胞質側が下(青)。構造はクライオ電子顕微鏡を用いて解明された[1]。 | |||||||||
| 識別子 | |||||||||
| 略号 | Gamma-secretase | ||||||||
| Pfam | PF05450 | ||||||||
| InterPro | IPR008710 | ||||||||
| OPM superfamily | 244 | ||||||||
| OPM protein | 5fn5 | ||||||||
| Membranome | 155 | ||||||||
| |||||||||
構造と組み立て
編集γ-セクレターゼのX線結晶構造はまだ得られていない[2]が、低分解能の電子顕微鏡像からの再構成によって、約2 nmの孔が可視化され[3]、2014年に完全なヒトγ-セクレターゼ複合体の三次元構造がクライオ電子顕微鏡(cryo-EM)を用いた単粒子解析によって 4.5 Åの分解能で決定され[3]、2015年には原子分解能(3.4 Å)のcryo-EM構造が報告された[1]。
γ-セクレターゼ複合体は、プレセニリン1[4]、ニカストリン、PEN-2(presenilin enhancer 2)、APH-1(anterior pharynx-defective 1)の4つのタンパク質から構成される[5]。
プレセニリン1(アスパラギン酸プロテアーゼの1つ)は、免疫細胞の活性を調節する機能があり[6]、触媒サブユニットでもある。γ-セクレターゼ複合体中のタンパク質は、複合体の組み立てまたは成熟の過程でタンパク質分解によって高度に修飾されるが、その活性化のためにプレセニリンのN末端フラグメントとC末端フラグメントへの自己触媒切断が必要である[4]。ニカストリンの主な役割は、組み立てられた複合体の安定性を維持し、細胞内のタンパク質輸送を調節することである[7]。PEN-2は、プレセニリンの膜貫通ドメインへの結合を介して複合体へ結合し[8]、プレセニリンがタンパク質分解によって活性化されたN末端フラグメントとC末端フラグメントとなった後の複合体の安定性を助ける役割などがある[9]。APH-1はタンパク質分解活性に必要であり、保存されたαヘリックス相互作用モチーフを介して複合体に結合し、未成熟な構成要素の組み立てを開始する[10]。
なお、ヒトのゲノム中には2種類のプレセニリンと2種類のAPH-1が同定されている。APHのホモログは選択的スプライシングによって2つのアイソフォームが発現するため、少なくとも6種類の異なるγ-セクレターゼが生じる可能性があり、組織または細胞種に関する特異性が存在している可能性がある[11]。
細胞輸送
編集γ-セクレターゼ複合体は、小胞体での組み立てとタンパク質分解によって成熟が行われると考えられている[12]。その後、複合体は分泌経路の後期区画へ送られ、そこで基質タンパク質と相互作用して切断を行う[13]。γ-セクレターゼ複合体はミトコンドリアにも局在することも観察されている[14]。
作用
編集γ-セクレターゼは、内在性膜タンパク質を膜貫通ドメイン内で切断する[15]。基質の認識はニカストリンの細胞外ドメインが標的のN末端に結合することによって行われる。その後、2つのプレセニリンフラグメント間での過程によって、触媒アスパラギン酸残基が位置する活性部位へと送られるが、その過程はあまり解明されていない。活性部位には、細胞膜の内側の疎水的環境で加水分解を行うための水分子が存在していなければならないが、水とのプロトン交換がどのよう行われているかはよく分かっていない[2]。
γ-セクレターゼが作用する最もよく知られた内在性膜タンパク質はアミロイド前駆体タンパク質(APP)である[16]。APPがγ-セクレターゼとβ-セクレターゼによって切断されることで、アミロイドβ(Aβ)が形成される[17]。γ-セクレターゼは、AβのC末端部分の産生に際し、"sloppy"(ずさん)な切断部位を残すという、プロテアーゼでは珍しい性質を持つ[17]。γ-セクレターゼはAPPを複数の個所のいずれかで切断し、典型的には39–42アミノ酸の範囲でさまざまなペプチドを作り出す。Aβ40が最も一般的なアイソフォームであり、アミロイド線維の形成を引き起こすコンフォメーション変化に対し最も感受性が高いのはAβ42である[16]。古いデータでは異なるγ-セクレターゼによって異なるAβのアイソフォームが形成される可能性が示唆されていたが[18]、同じγ-セクレターゼによる1残基ごとの一連の切断によってAβのC末端が産生されていることがその後のエビデンスから示唆されている[16][17][19]。なお、初期の切断部位では46アミノ酸(ζ切断)や49アミノ酸(ε切断)のペプチドが産生される[17]。
近年の研究では、γ-セクレターゼとγ-セクレターゼ活性化タンパク質との相互作用がAPPからAβへの切断を促進することが示されている[15]。また、CD147が存在しないとγ-セクレターゼの活性が上昇するという研究結果から、CD147が非必須調節因子であることが示唆されている[20][21]。
γ-セクレターゼによるAPPの切断によって生成されるAβは、線維型の異常なフォールディング(ミスフォールディング)によってアルツハイマー病患者に見られるアミロイド斑の主成分となるため、アルツハイマー病と関連が研究されている[22]。早発型の家族性アルツハイマー病の発症は、APP自体の変異だけでなく、γ-セクレターゼを構成するプレセニリンの異常が因子となることが指摘されている[22]。プレセニリン遺伝子の変異はアルツハイマー病の主要な危険因子であることが示されている[23]。
このほか、γ-セクレターゼは、Notch[24]、ErbB4[25]、E-カドヘリン[26]、N-カドヘリン[27]、エフリンB2[28]、CD44[29]など、他のI型膜タンパク質のプロセシングにも重要な役割を果たしていると考えられる。
出典
編集- ^ a b Bai, Xiao-chen; Yan, Chuangye; Yang, Guanghui; Lu, Peilong; Ma, Dan; Sun, Linfeng; Zhou, Rui; Scheres, Sjors H. W. et al. (17 August 2015). “An atomic structure of human γ-secretase”. Nature 525 (7568): 212–217. doi:10.1038/nature14892. PMC 4568306. PMID 26280335.
- ^ a b Wolfe MS (July 2006). “The gamma-secretase complex: membrane-embedded proteolytic ensemble”. Biochemistry 45 (26): 7931–9. doi:10.1021/bi060799c. PMID 16800619.
- ^ a b “Electron microscopic structure of purified, active γ-secretase reveals an aqueous intramembrane chamber and two pores”. Proc. Natl. Acad. Sci. U.S.A. 103 (18): 6889–94. (May 2006). doi:10.1073/pnas.0602321103. PMC 1458989. PMID 16636269.
- ^ a b Sobhanifar, S; Schneider, B; Löhr, F; Gottstein, D; Ikeya, T; Mlynarczyk, K; Pulawski, W; Ghoshdastider, U et al. (25 May 2010). “Structural investigation of the C-terminal catalytic fragment of presenilin 1.”. Proceedings of the National Academy of Sciences of the United States of America 107 (21): 9644–9. doi:10.1073/pnas.1000778107. PMC 2906861. PMID 20445084.
- ^ “Assembly, trafficking and function of gamma-secretase”. Neurodegener Dis 3 (4–5): 275–83. (2006). doi:10.1159/000095267. PMID 17047368.
- ^ “g secretase component presenilin is important for microglia b-Amyloid clearance”. Annals of Neurology 69 (1): 170–80. (November 2010). doi:10.1002/ana.22191. PMID 21280087.
- ^ “Nicastrin Is Critical for Stability and Trafficking but Not Association of Other Presenilin/γ-Secretase Components”. J. Biol. Chem. 280 (17): 17020–6. (April 2005). doi:10.1074/jbc.M409467200. PMC 1201533. PMID 15711015.
- ^ “Pen-2 is incorporated into the gamma-secretase complex through binding to transmembrane domain 4 of presenilin 1”. J. Biol. Chem. 280 (51): 41967–75. (December 2005). doi:10.1074/jbc.M509066200. PMID 16234244.
- ^ “Requirement of PEN-2 for stabilization of the presenilin N-/C-terminal fragment heterodimer within the gamma-secretase complex”. J. Biol. Chem. 279 (22): 23255–61. (May 2004). doi:10.1074/jbc.M401789200. PMID 15039426.
- ^ “A conserved GXXXG motif in APH-1 is critical for assembly and activity of the gamma-secretase complex”. J. Biol. Chem. 279 (6): 4144–52. (February 2004). doi:10.1074/jbc.M309745200. PMID 14627705.
- ^ Shirotani, K; Edbauer, D; Prokop, S; Haass, C; Steiner, H. (2004). “Identification of distinct gamma-secretase complexes with different APH-1 variants”. J Biol Chem 279 (40): 41340–5. doi:10.1074/jbc.M405768200. PMID 15286082.
- ^ “Gamma-secretase complex assembly within the early secretory pathway”. J. Biol. Chem. 280 (8): 6471–8. (February 2005). doi:10.1074/jbc.M409106200. PMID 15591316.
- ^ “Evidence that assembly of an active gamma-secretase complex occurs in the early compartments of the secretory pathway”. J. Biol. Chem. 279 (47): 48615–9. (November 2004). doi:10.1074/jbc.C400396200. PMID 15456788.
- ^ a b “Nicastrin, presenilin, APH-1, and PEN-2 form active gamma-secretase complexes in mitochondria”. J. Biol. Chem. 279 (49): 51654–60. (December 2004). doi:10.1074/jbc.M404500200. PMID 15456764.
- ^ a b “Gamma-secretase activating protein, a therapeutic target for Alzheimer's disease”. Nature 467 (2): 95–98. (September 2010). doi:10.1038/nature09325. PMC 2936959. PMID 20811458.
- ^ a b c “The same gamma-secretase accounts for the multiple intramembrane cleavages of APP”. J. Neurochem. 100 (5): 1234–46. (March 2007). doi:10.1111/j.1471-4159.2006.04302.x. PMID 17241131.
- ^ a b c d Zhang, H; Ma, Q; Zhang, YW; Xu, H (January 2012). “Proteolytic processing of Alzheimer's β-amyloid precursor protein.”. Journal of Neurochemistry 120 Suppl 1: 9–21. doi:10.1111/j.1471-4159.2011.07519.x. PMC 3254787. PMID 22122372.
- ^ “Mutant presenilins specifically elevate the levels of the 42 residue beta-amyloid peptide in vivo: evidence for augmentation of a 42-specific gamma secretase”. Hum. Mol. Genet. 13 (2): 159–70. (January 2004). doi:10.1093/hmg/ddh019. PMID 14645205.
- ^ Haass, C; Kaether, C; Thinakaran, G; Sisodia, S (May 2012). “Trafficking and proteolytic processing of APP.”. Cold Spring Harbor Perspectives in Medicine 2 (5): a006270. doi:10.1101/cshperspect.a006270. PMC 3331683. PMID 22553493.
- ^ “The discovery and role of CD147 as a subunit of gamma-secretase complex”. Drug News Perspect. 19 (3): 133–8. (April 2006). doi:10.1358/dnp.2006.19.3.985932. PMID 16804564.
- ^ “CD147 is a regulatory subunit of the γ-secretase complex in Alzheimer's disease amyloid β-peptide production”. Proc. Natl. Acad. Sci. U.S.A. 102 (21): 7499–504. (May 2005). doi:10.1073/pnas.0502768102. PMC 1103709. PMID 15890777.
- ^ a b “Familial Alzheimer's disease mutations inhibit gamma-secretase-mediated liberation of beta-amyloid precursor protein carboxy-terminal fragment”. J. Neurochem. 94 (5): 1189–201. (September 2005). doi:10.1111/j.1471-4159.2005.03266.x. PMID 15992373.
- ^ “TMP21 is a presenilin complex component that modulates gamma-secretase but not epsilon-secretase activity”. Nature 440 (7088): 1208–12. (April 2006). doi:10.1038/nature04667. PMID 16641999.
- ^ “A presenilin-1-dependent gamma-secretase-like protease mediates release of Notch intracellular domain”. Nature 398 (6727): 518–22. (1999). doi:10.1038/19083. PMID 10206645.
- ^ “gamma -Secretase cleavage and nuclear localization of ErbB-4 receptor tyrosine kinase”. Science 294 (5549): 2179–81. (2001). doi:10.1126/science.1065412. PMID 11679632.
- ^ “A presenilin-1/gamma-secretase cleavage releases the E-cadherin intracellular domain and regulates disassembly of adherens junctions”. EMBO J 21 (8): 1948–56. (2002). doi:10.1093/emboj/21.8.1948. PMC 125968. PMID 11953314.
- ^ “A CBP binding transcriptional repressor produced by the PS1/epsilon-cleavage of N-cadherin is inhibited by PS1 FAD mutations”. Cell 114 (5): 635–45. (2003). doi:10.1016/j.cell.2003.08.008. PMID 13678586.
- ^ “Metalloproteinase/Presenilin1 processing of ephrinB regulates EphB-induced Src phosphorylation and signaling”. EMBO J 25 (6): 1242–52. (2006). doi:10.1038/sj.emboj.7601031. PMC 1422162. PMID 16511561.
- ^ “Presenilin-dependent intramembrane proteolysis of CD44 leads to the liberation of its intracellular domain and the secretion of an Abeta-like peptide”. J Biol Chem 277 (47): 44754–9. (2002). doi:10.1074/jbc.M206872200. PMID 12223485.
関連項目
編集- DAPT - γ-セクレターゼ阻害剤