2-ヨードキシ安息香酸
2-ヨードキシ安息香酸(2-ヨードキシあんそくこうさん、英: 2-iodoxybenzoic acid)は、有機合成化学で使われる酸化剤である。IBX または IBX acid の略称で呼ばれる。この超原子価ヨウ素化合物は、温和な条件下ではたらく酸化剤であり、特にアルコールを酸化してアルデヒドに変える目的に適している。
| 2-ヨードキシ安息香酸 | |
|---|---|
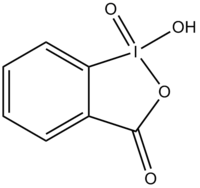
| |

|

|
別称 1-hydroxy-1λ5,2-benziodoxol-1,3-dione 1-hydroxy-1λ3,2-benziodoxol-3(1H)-one 1-oxide | |
| 識別情報 | |
| CAS登録番号 | 61717-82-6 |
| PubChem | 339496 |
| ChemSpider | 300947 |
| ChEMBL | CHEMBL118857 |
| |
| |
| 特性 | |
| 化学式 | C7H5IO4 |
| モル質量 | 280.02 g/mol |
| 危険性 | |
| Rフレーズ | R22 R34 R44 |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
調製
編集2-ヨードキシ安息香酸は、2-ヨード安息香酸を希硫酸中で臭素酸カリウムによって酸化して得られる。[1]。1999年に Frigerio によって、臭素酸カリウムの代わりに市販のオキソンを使う合成法が報告された[2]。2-ヨードキシ安息香酸の唯一の欠点は普通に使われる有機溶媒に溶けにくいことである。DMSO に溶解するため、これを反応溶媒として使用するのが一般的である。市販されている 2-ヨードキシ安息香酸は安息香酸やイソフタル酸のようなカルボン酸が安定剤として添加されている。
反応機構
編集IBX がアルコールをアルデヒドに酸化する反応機構は超原子価ひねり機構 (hypervalent twisting mechanism[3]) と呼ばれている。この反応機構は IBX のヒドロキシ基のアルコールとの置換、原子価のひねりによる結合位置の交換、アルデヒドの脱離の三段階からなる。三段階目のアルデヒドの脱離はアルコールの炭素上の水素が IBX の二重結合上の酸素へ移動するのと協奏的に進行する。一段階目が終了した時点では二重結合上の酸素はアルコールとは異なる方向を向いているので、この水素移動反応を起こすことができない。二段階目の原子価のひねりによって、二重結合上の酸素はアルコールからの水素移動反応の5員環遷移状態を形成するのに適した場所に位置する。またこの段階が律速段階であることが計算機化学によって示されている。この反応機構からは、なぜ立体的にかさ高いアルコールの方が IBX によってより速く酸化されるのか、ということも説明できる。原子価のひねりの段階は IBX 上のヨウ素のオルト位の水素とアルコール上の水素の間の立体反発によって加速される。立体的にかさ高いアルコールではより大きな立体反発が生じるため、酸化がより加速されることになる。同じ計算機化学によれば、オルト位の水素をメチル基に置換したIBX誘導体では原子価のねじれが非常に容易に起こり、脱離反応の段階が律速段階として優勢になり、反応速度が100倍加速することが予想されている。
IBX はラクトン型とカルボン酸型の2つの互変異性体として存在するため酸性を示す。その pKa は水中で2.4、DMSO 中で6.65と決定されている[4]。この酸性により酸化の際に異性化を引き起こすことがある。
IBX酸化の適用範囲
編集IBX はシリカゲルやポリスチレンに担持しても利用できる。デス・マーチン・ペルヨージナン (DMP) は IBX から合成可能であり、多くの有機溶媒に溶解するため IBX の代わりによく用いられる。IBX による酸化はエイコサノイドの全合成に使用された[5]。
2000-2001年にキリアコス・コスタ・ニコラウらはベンジル位炭素をカルボニル基に酸化するなどの IBX 酸化に関する一連の論文を米国化学会誌に発表した[6]。
酸化的開裂
編集IBX を DMSO とともに使用することで、1,2-ジオールをケトンに酸化的開裂させることができる[7]。
このグリコール開裂の反応機構は、まず IBX に DMSO が付加した付加体が生成し、続いてDMSOが脱離基となって代わりに1,2-ジオールがヨウ素に結合する。続いてヨウ素上のOHが1,2-ジオールの遊離のアルコールの水素とともに水として脱離し、スピロ型二環性の中間体が生じる。最後に1,2-ジオール由来の5員環の開裂が起こる。この開裂反応は、ヒドロキシ基のある炭素上に水素がある場合にはアシロインへの酸化と競合する。トリフルオロ酢酸によって反応が促進されることが判明している。
脚注
編集- ^ Robert K. Boeckman, Jr., Pengcheng Shao, and Joseph J. Mullins (2000). “Dess-Martin periodinane: 1,1,1-Triacetoxy-1,1-dihydro-1,2-benziodoxol-3(1H)-one [1,2-Benziodoxol-3(1H)-one, 1,1,1-tris(acetyloxy)-1,1-dihydro-]”. Organic Syntheses 77: 141. (also in the Collective Volume (2004) 10:696 Archived 2007年09月30日, at the Wayback Machine. (PDF)).
- ^ M. Frigerio, M. Santagostino and S. Sputore (1999). “A User-Friendly Entry to 2-Iodoxybenzoic Acid (IBX)”. J. Org. Chem. 64 (12): 4537–4538.
- ^ Julius T. Su and William A. Goddard III (2005). “Enhancing 2-Iodoxybenzoic Acid Reactivity by Exploiting a Hypervalent Twist”. J. Am. Chem. Soc. 127 (41): 14146–14147. doi:10.1021/ja054446x.
- ^ Michael J. Gallen, Régis Goumont, Timothy Clark, François Terrier, Craig M. Williams (2006). “o-Iodoxybenzoic Acid (IBX): pKa and Proton-Affinity Analysis”. Angew. Chem. Int. Ed. 45 (18): 2929–2934. doi:10.1002/anie.200504156.
- ^ Debendra K. Mohapatra and Gorakhanath S. Yellol. “Asymmetric total synthesis of eicosanoid”. Arkivoc 2005 (iii).
- ^ K. C. Nicolaou, Phil S. Baran, and Yong-Li Zhong (2001). “Selective Oxidation at Carbon Adjacent to Aromatic Systems with IBX”. J. Am. Chem. Soc. 123 (13): 3183-3185.
- ^ Jarugu Narasimha Moorthy, Nidhi Singhal and Kalyan Senapati (2007). “Oxidative cleavage of vicinal diols: IBX can do what Dess–Martin periodinane (DMP) can't”. Org. Biomol. Chem. 5: 767–771. doi:10.1039/b618135j.