三塩化酸化バナジウム(V)
三塩化酸化バナジウム(V)(さんえんかさんかバナジウム ご、英: vanadium(V) trichloride oxide)は、化学式が VOCl3 と表されるバナジウムの化合物である。常温で液体で、蒸留は可能だが空気中で直ちに加水分解される。強い酸化剤であり、主に有機合成の試薬として用いられる[1]。毒物及び劇物取締法により劇物に指定されている[2]。
| 三塩化酸化バナジウム(V) | |
|---|---|

| |
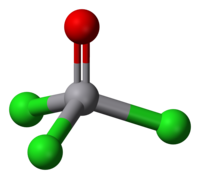
| |
vanadium(V) trichloride oxide | |
別称 オキシ三塩化バナジウム 三塩化バナジル | |
| 識別情報 | |
| CAS登録番号 | 7727-18-6 |
| RTECS番号 | YW2975000 |
| 特性 | |
| 化学式 | VOCl3 |
| モル質量 | 173.30 g/mol |
| 外観 | 黄褐色液体 |
| 密度 | 1.84 g/cm3, 液体 |
| 融点 |
-76.5 °C |
| 沸点 |
126–27 °C (400 K) |
| 水への溶解度 | 水と反応 |
| 塩素系溶媒への溶解度 | 可溶 |
| 構造 | |
| 分子の形 | 四面体形 |
| 危険性 | |
| 主な危険性 | 有毒 (T) 加水分解で塩化水素を発生 |
| NFPA 704 | |
| 関連する物質 | |
| 関連するバナジウムの化合物 | 酸化バナジウム(V) 塩化バナジウム(IV) 三フッ化酸化バナジウム(V) |
| 関連物質 | 塩化ホスホリル |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
化学的性質
編集三塩化酸化バナジウム(V)はバナジウム(V)の化合物で、反磁性である。四面体形構造を持ち、O-V-Cl 角は111度、Cl-V-Cl 角は108度、V-O 結合長は 157 pm、V-Cl 結合長は 214 pm である。非常に水と反応性が高く、放置しておくと塩素が発生する。無極性溶媒(ベンゼン、ジクロロメタン、ヘキサンなど)に可溶である。塩化ホスホリルとは類似点もあるが、塩化二酸化バナジウム(V)には酸化性があるという点で異なっている。一般にリン化合物には酸化性はない[3]。
合成
編集VOCl3 は、酸化バナジウム(V)の塩素化によって合成できる。この反応は約600 °C程度で進行する[4]。
V2O5 と炭素との混合物を用いれば、この反応は200-400 °Cで進行させることが可能である。この場合炭素は、TiO2 から TiCl4 を製造するクロール法と同じように脱酸素剤として作用する。
前駆体として酸化バナジウム(III)が使われることもある。
実験室レベルでは、塩化チオニルによって酸化バナジウム(V)を塩素化して合成する[5]。
反応
編集加水分解とアルコール分解
編集VOCl3 は、速やかに V2O5 と HCl に加水分解される。ビーカーの中に入れておくと、壁面に V2O5 が生成しているのが見られる。反応中間体として塩化二酸化バナジウム(V)が発生する。
VOCl3 はトリエチルアミンなどの塩基の存在下、アルコールをアルコキシドに変化させる。
- (R = Me、Ph など)
他の塩化酸化物への変化
編集VOCl3 は VOCl2 の合成においても使われる。
塩化二酸化バナジウム(V)は、一酸化二塩素を用いる特殊な反応によって合成される[6]。
VO2Cl は180 °Cより高い温度で V2O5 と VOCl3 に分解する。同様に、VOCl2 も VOCl3 と VOCl に分解する。
錯体の構造
編集VOCl3 は強力なルイス酸であり、アセトニトリルやアミンなどと錯体を作る傾向がある。錯体を作る際、バナジウムは4配位四面体形構造から6配位八面体形構造に変化する。
アルケンの重合
編集VOCl3 はエチレンプロピレンゴム (EPDM) の合成の触媒、または前駆触媒として使われる。
脚注
編集- ^ M. O'Brien, B. Vanasse (2001). Encyclopedia of Reagents for Organic Synthesis
- ^ 毒物及び劇物指定令 昭和四十年一月四日 政令第二号 第二条 十八の三
- ^ A. Earnshaw, N. Greenwood (1997). The Chemistry of the Elements - Second Edition. pp. 513–514
- ^ A. Holleman, E. Wiberg (2001). Inorganic Chemistry
- ^ S. Tyree (1967). Inorganic Syntheses Volume IX. p. 80
- ^ H. Oppermann, "Gleichgewichte mit VOCl3, VO2Cl, VOCl2" Zeitschrift für Anorganische und Allgemeine Chemie, vol. 331. 113-126 (1967)
