リモネン-1,2-エポキシドヒドロラーゼ
リモネン-1,2-エポキシドヒドロラーゼ(Limonene-1,2-epoxide hydrolase、EC 3.3.2.8)は、以下の化学反応を触媒する酵素である。
| リモネン-1,2-エポキシドヒドロラーゼ触媒ドメイン | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| 識別子 | |||||||||
| 略号 | LEH | ||||||||
| Pfam | PF07858 | ||||||||
| Pfam clan | CL0051 | ||||||||
| InterPro | IPR013100 | ||||||||
| SCOP | 1nww | ||||||||
| SUPERFAMILY | 1nww | ||||||||
| OPM superfamily | 141 | ||||||||
| OPM protein | 2bng | ||||||||
| |||||||||
| リモネン-1,2-エポキシドヒドロラーゼ | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| 識別子 | |||||||||
| EC番号 | 3.3.2.8 | ||||||||
| データベース | |||||||||
| IntEnz | IntEnz view | ||||||||
| BRENDA | BRENDA entry | ||||||||
| ExPASy | NiceZyme view | ||||||||
| KEGG | KEGG entry | ||||||||
| MetaCyc | metabolic pathway | ||||||||
| PRIAM | profile | ||||||||
| PDB構造 | RCSB PDB PDBj PDBe PDBsum | ||||||||
| 遺伝子オントロジー | AmiGO / QuickGO | ||||||||
| |||||||||
- リモネン-1,2-エポキシド + 水リモネン-1,2-ジオール
従って、この酵素の基質はリモネン-1,2-エポキシドと水の2つ、生成物はリモネン-1,2-ジオールのみである。
この酵素は加水分解酵素、特にエーテル結合に作用するエーテル加水分解酵素に分類される。系統名は、リモネン-1,2-エポキシドヒドロラーゼである。この酵素は、リモネンやピネンの分解に関与している。
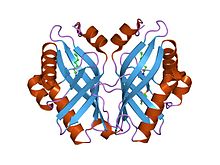
エポキシド加水分解酵素は、エポキシドを対応するジオールに加水分解する反応を触媒する。この反応は、解毒、シグナル分子の合成、代謝等にとって重要である。リモネン-1,2-エポキシドヒドロラーゼは、その構造や一段階機構である点で、他の多くのエポキシド加水分解酵素と異なる。フォールディングは、6つのβシートと3つのN末端αヘリックスが一方に詰め込まれ、ポケットを形成してタンパク質の核部分に伸びる構造をしている。4番目のヘリックスがこのポケットの縁に位置している。ここには主に疎水性残基が並んでいるが、最も深い部分には極性基が固まっており、酵素の活性部位を形成している[1]。
出典
編集- ^ Arand M, Hallberg BM, Zou J, Bergfors T, Oesch F, van der Werf MJ, de Bont JA, Jones TA, Mowbray SL (June 2003). “Structure of Rhodococcus erythropolis limonene-1,2-epoxide hydrolase reveals a novel active site”. EMBO J. 22 (11): 2583-92. doi:10.1093/emboj/cdg275. PMC 156771. PMID 12773375.
関連文献
編集- van der Werf MJ, Overkamp KM, de Bont JA (1998). “Limonene-1,2-epoxide hydrolase from Rhodococcus erythropolis DCL14 belongs to a novel class of epoxide hydrolases”. J. Bacteriol. 180 (19): 5052–7. PMC 107539. PMID 9748436.
- Barbirato F, Verdoes JC, de Bont JA, van der Werf MJ (1998). “The Rhodococcus erythropolis DCL14 limonene-1,2-epoxide hydrolase gene encodes an enzyme belonging to a novel class of epoxide hydrolases”. FEBS. Lett. 438 (3): 293–6. doi:10.1016/S0014-5793(98)01322-2. PMID 9827564.
