フタル酸
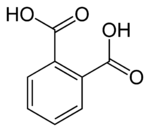
フタル酸(フタルさん、Phthalic acid)は示性式 C6H4(COOH)2 のベンゼンジカルボン酸である。狭義にはオルト体をフタル酸と呼ぶが、他異性体を含めたベンゼンジカルボン酸の総称もまたフタル酸(類)と呼称される。メタ体はイソフタル酸、パラ体はテレフタル酸とも呼ばれる。
| フタル酸 | |
|---|---|
| |

| |
別称 ベンゼン-1,2- ジカルボン酸 | |
| 識別情報 | |
| CAS登録番号 | 88-99-3 |
| EC番号 | 201-873-2 |
| |
| 特性 | |
| 化学式 | C8H6O4 |
| モル質量 | 166.14 g/mol |
| 外観 | 白色の固体 |
| 密度 | 1.593 g/cm3, 固体 |
| 融点 |
210 °C (分解) |
| 水への溶解度 | 0.72 g/100g溶液 (26 ℃) |
| 酸解離定数 pKa | 2.94, 5.41 |
| 熱化学 | |
| 標準生成熱 ΔfH |
−782.0 kJ mol−1 |
| 危険性 | |
| NFPA 704 | |
| 関連する物質 | |
| 関連するカルボン酸 | イソフタル酸 テレフタル酸 |
| 関連物質 | 無水フタル酸 フタルイミド フタルヒドラジン |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |

遊離酸型のフタル酸類は一般的に、昇華性を有する無色固体で水にも有機溶媒にも溶けにくく、極性の高い有機溶媒に溶けやすいといった性質を示す。
フタル酸類は合成樹脂のモノマーとして利用されたり、特にエステル体の一部は、熱可塑性樹脂の可塑剤として30% - 70%w/wほど添加される。
フタル酸類の製造法
編集フタル酸類は側鎖を持つシ置換ベンゼン誘導体を酸化することで製造される。アルキルベンゼンの酸化は強い酸化剤が必要で、通常この種の条件では、原料の種類を問わずアルキルベンゼンのα位(ベンジル位)が酸化されたベンゼンジカルボン酸が生成される。実験室ではアルカリ性水溶液下で過マンガン酸カリウムなどの強酸化剤が使用されるが、工業的には五酸化バナジウムなどの担体保持された触媒による空気酸化が利用される。工業的エステル化は主に過剰な原料アルコールの一部を共沸脱水に利用する方法で製造される。
フタル酸類およびフタル酸類エステル体の工業的製造法には次のものがある。
- フタル酸製造法(図の経路1 - 3 - 4、経路2 - 3 - 4)
- フタル酸(o-体)の工業的製造法の原料は、古くは石炭化学の副産物であるナフタレン(1)が利用されたが、1960年代を境に、今日では石油化学の副産物であるo-キシレン(2)が原料として利用される。触媒空気酸化(BASF法)によるフタル酸合成(o-体)の場合はフタル酸無水物(3)が生成される。遊離酸が必要な場合は、加水分解してフタル酸(4)とするが、誘導体原料としてはフタル酸無水物(3)がそのまま利用される。
- フタル酸エステル製造法(図の経路3 - 6)
- フタル酸無水物(3)と目的物に該当するアルコールを反応させると、一旦ハーフエステル体(モノエステル体)(5)が得られる。さらに原料アルコールを加熱還流し、水を共沸により反応系外へ除去することでジエステル体(6)が得られる。
- イソフタル酸製造法(図の経路7 - 8)
- イソフタル酸(8)はもっぱら、m-キシレン(7)を原料とし、テレフタル酸と同様な触媒空気酸化(Amoco法等)により製造される。
- イソフタル酸エステル製造法(図の経路8 - 9)
- イソフタル酸(8)と目的物に該当するアルコールとを共沸脱水することで目的のジエステル体(9)が得られる。
- テレフタル酸製造法
- テレフタル酸(12)の製造法としては、p-キシレン(10)を原料とするAmoco法、フタル酸ジカリウム塩(16)を原料とする第一Henkel法、二分子の安息香酸カリウム塩を原料とする第一Henkel法、p-キシレン(10)をアンモ酸化したフタロニトリル(18)をアルカリ加水分解する方法などが知られている。
- Amoco法(図の経路10 - 15)
- Mn塩あるいはCo塩を利用する液相空気酸化でp-キシレン(10)を空気酸化する場合は、一段階目のp-トルイル酸(11)で酸化反応が停止する欠点がある。これを反応系内にメタノール等を共存させ、生成される11を系中でエステル体(13)として、二段階目の酸化反応とエステル化反応を経てジメチルテレフタレート(Dimethyl terephtalate, 15)を介してテレフタル酸(12)を製造する。この方法の利点は遊離酸もジエステル体もポリエチレンテレフタレート(ポリエステル)の原料モノマーであることと、テレフタル酸(12)が高沸点、難溶化合物であり、合成繊維向けグレードの高純度製品に精製が困難である欠点を、精製が容易なジエステル体段階で精製することで回避できる点である。
- 第一Henkel法(図の経路16 - 12)
- フタル酸ジカリウム塩16をZn-Cd触媒で転位反応させテレフタル酸(12)へと異性化する方法が知られている。この方法は開発したHenkel社にちなんで第一Henkel法とも呼ばれる。コスト面でAmoco法に対して不利であることから今日では利用されない。
- 第二Henkel法(図の経路17 - 12)
- 第一Henkel法のZn-Cd触媒は安息香酸カリウム塩(17)の分子間転移反応にも適用できる為、第二Henkel法と呼ばれる。すなわち、安息香酸カリウム塩は触媒による不均化反応で、テレフタル酸(12)とベンゼンとに変換される。第一Henkel法同様、今日では利用されない。
- アンモ酸化法(図の経路10 - 18 - 12)
- テレフタル酸エステル製造法(図の経路12 - 15)
- Amoco法ではジメチルフタレートが中間体として得られるが、他の方法で製造したテレフタル酸(12)や違う種類のエステルは、該当するアルコールと共沸脱水することでジエステル体(15)が得られる。
フタル酸および誘導体
編集フタル酸(オルト体)
編集化学式C8H6O4、分子量166.13の昇華性を持つ無色柱状結晶で、融点191℃(封管中)である。CAS登録番号は88-99-3。
231℃以上で分解しつつ融解して、水分子を放出した無水フタル酸へと変化する。硫酸など脱水剤の存在下でも無水フタル酸を与える。
フタル酸水素塩はIUPACにより、水および誘電率の高い有機溶媒中において、その0.05mol/kg(solvent)溶液をpH一次標準として用いることが提案された。
フタル酸無水物
編集フタル酸無水物(-さんむすいぶつ、Phthalic Anhydride)はフタル酸の分子内酸無水物で、化学式C8H4O3、分子量148.12、融点130.8℃、沸点295℃の昇華性を持つ無色結晶である。CAS登録番号は85-44-9。フタル酸誘導体の合成原料として重要。
フタルイミド
編集フタルイミド(Phthalimide)は、フタル酸(0-benzenedicarboxylic acid)の分子内イミド化合物である。C8H5NO2分子量147.13、融点238℃の昇華性のあるプリズム晶。CAS登録番号は85-41-6。天然にはクラドノ石として産出するが希産である。
無水フタル酸とアンモニアあるいは炭酸アンモニウムとを加熱して製造する[1]。ヘキサン、エーテル、ベンゼン、クロロホルム、水等には溶けず、DMF、熱時アルコール、酢酸には溶解する。フタルイミドのイミド水素の酸性度は高く (Ka=5×10−9) 濃いアルカリ水溶液にはよく溶ける。フタルイミド塩は求核性も高く、フタルイミドカリウム塩はアルキルハライド等と反応させるガブリエル合成と呼ばれる一置換アミン合成法の原料として有用である(記事 ガブリエル合成に詳しい)。
フタル酸エステル
編集フタル酸塩
編集フタル酸は二塩基酸であるため酸性塩および正塩が存在する。アルカリ金属、アンモニウムおよびアルカリ土類金属のフタル酸塩は水に溶ける。
酸性塩であるフタル酸水素カリウム C6H4(COOH)(COOK)は純品が得やすく、緩衝溶液としての能力も高いため、pH測定において一次標準物質として用いられる。
その他フタル酸関連物質
編集フタル酸誘導体は染料、医薬品の原料として種々の化合物に関連が深い。主なものを次に示す
